11. 전위차 적정법 이론 및 실습
1. 전위차 적정법 개요.
적정에 의한 부피의 분석은 보통 발색 지시약을 사용하여 편리하게 수행 할 수 있다. 그러나 적당한 지시약이 없으면 전위차법에 의한 종말점을 찾게 될 수도 있다.
전기적정법은 산염기적정, 산화환원적정, 착염적정, 침전 적정 등의 각 방법에 있어서 당량점 부근에 있어서 피정량질 또는 적정 시약의 활량이 소실 또는 출현하는 등으로 급격한 변화를 일으키므로 그것을 전기 신호로 나타내어 적정의 종말점을 구하여 정량분석 실험을 하는 방법의 하나이다.
전위차법의 특징은 지시약을 사용하는 경우보다 훨씬 더 민감하게 당량점을 찾을 수 있다. 전위가 용액의 성분중 활동도에 따라 변하기 때문에 가장 정확한 분석법중의 하나이다.
전위차 적정법은 전극간의 전위차(기전력)을 측정하여 최종 종말점을 알아내는 적정방법이며 적정한 전극대를 써서 기전력의 변화를 점검하여 적정량차 ᇫV에 대한 기전력의 변화 ᇫE의 비, ᇫE/ᇫV가 극대로 되는 점으로부터 적정의 종말점을 얻든가 또는 당량점에 해당하는 기전력의 값으로부터 적정의 종말점을 얻는다.
2. 0.1N - AgNO3로 AT-HCl 중의 HCl 함량분석(예시)
2.1 1N-NaOH 표준물질
1) 조제자 : Merk 사
2) Batch No. : OC331884
3) 조제일 : 2003.11.03
4) 유효기간 : 2006 07.31
2.2 실험절차
1) AT-HCl을 약 300g무게를 달아 증류수 약 40ml에 녹인다.
2) 0.1N - AgNO3로 전위차 적정을 실시한다.
3. 실험결과(예시)
3.1 계산법
AT-HCl 중 HCl의 함량(%) = { (V - B) × 3.646 ×f / W } × 100
0.1N AgNO3 1ml = 3.646 mg HCl
3.2 측정한 데이터 및 계산
1) 셈플의 질량
(단위:g)
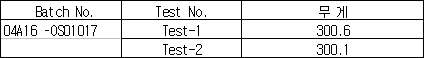
1) 함량계산
(단위 : %)
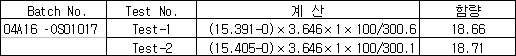
3.3 결과
1) AT-HCl –OS01017 중의 HCl함량 테스트 결과 약 18.68% 로 나왔다.
4. 표준시약 1N-HCl로 Ammonia Water (NH4OH) 중의 NH3함량분석(예시)
4.1 1N-HCl 표준물질
1) 조제자 : Merk 사
2) Batch No. : OC326143
3) 조제일 : 2004.01.28
4) 유효기간 : 2006.06.30
4.2 실험절차
1) 함량을 모르는 NH4OH 1ml를 정밀히 달아 물50ml에 넣고 잘 섞는다.
2) 1N–HCl 로 전위차 적정을 실시한다.
5. 실험결과(예시)
5.1 계산법
Ammonia Water의 함량(%) = { (V - B) × 17.03 ×f / W } × 100
1N-HCl 1ml = 17.03 mg NH3
5.2 측정한 데이터 및 계산
1) 셈플의 무게
(단위:g)
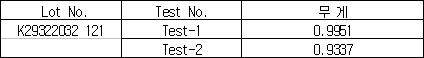
2) 함량계산
(단위 : %)
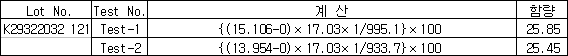
5.3 실험결과
Ammonia Water (NH4OH) 중의 NH3함량을 분석한 결과 약 25.65%의 결과 값 이 측정됨.
5.4 토의
암모니아 함량의 편차가 높게 나온 것은 암모니아의 무게를 측정한 후 암모니아의 휘발에 의하여 오차가 발생한 것으로 판단되고 차후 실험에서 휘발성 물질은 주의 해야함을 숙지했다.